医薬品開発分野でのデータ量が爆発的に増加‐IT環境の複雑性を解消して新たな医薬品開発を提案

医薬品・医療機器開発の治験・市販後調査分野では、国際共同治験の増加を背景に、製薬企業が保有する情報量が大幅に増加し、また治験に関わる組織の多様化が加速している。今後は、複数の部門が連携したデータの一元管理が大きな課題となるだろう。こうした中、日本オラクルは「現場」と「経営」の二つの視点に基づいた、新たなITの提案に取り組んでいる。データ共有の複雑性を解消して事業全体を「可視化」し、医薬品開発分野で新たな事業戦略を導くシステム基盤の提供だ。執行役員ヘルスサイエンス・グローバルビジネスユニットゼネラルマネージャーの櫻井ステファン氏に、製薬企業向けの事業戦略について聞いた。
データ一元管理の時代へ‐事業全体を「可視化」
急速にIT化が進む製薬業界ですが、全事業領域で最も遅れていたのが臨床開発領域です。医薬品製造での品質管理、営業分野での販売支援、創薬研究での遺伝子解析など、他領域で先行して導入が進み、ようやく最後に臨床開発領域へと波及してきました。GCPなどの規制のしばりや、治験の実施主体が医療機関で、製薬企業が関与しにくい特殊な事業領域ということもあって、ITが医薬品開発でブレークスルーを起こすまでに時間がかかったのです。
しかし製薬企業のグローバル化と医薬品開発期間の大幅な短縮のニーズを背景に、医薬品医療機器総合機構の調べによると、ここ10年で50社以上の製薬企業やCROが「EDCシステム」を導入するなど、急速に治験の電子化が広がりました。新薬の世界同時開発が急増し、それに合わせて治験業務プロセスの効率化やデータ管理体制の強化が迫られた結果、ITシステムの導入が必要不可欠になってきたのです。
現在では、インターネットを介して被験者情報を収集する「EDCシステム」を突破口に、治験に関連したあらゆる業務でIT製品が登場してきています。これらは各業務プロセスの効率化に一役を買い、データ収集の期間短縮などで成果を上げています。
一方、治験関連の組織が多様化し、データの集中管理が叫ばれるようになりました。各部門で得たデータをそれぞれに管理・活用していく業務プロセスに偏り、承認申請プロセス全体でのデータ管理に問題を抱え、新薬の承認申請が難航する事例も多いようです。さらに、厚生労働省のデータによると治験届出数が2006年からの6年間で55%増加するなど、製薬企業が保有する情報量が年々増加するのと同時に、情報共有の複雑性が高まり、情報連携を難しくさせています。
製薬各社がグローバルで開発競争を進める中、各部門の業務プロセス中心の考え方から、全業務の最適化に向けたデータ管理へと移行していかなくてはならないと思います。
日本オラクルが目指す事業ビジョンは、臨床データ管理、臨床検査データ、安全性、症例登録、患者日誌、臨床データ管理、コーディング、品質管理、臨床試験管理、統計プログラム、EDCと各部門で管理する体制から、各部署からのデータを集めて一元管理する体制への転換です。各部門で使われているシステムを相互につなぎ、全データを一元管理できるテクノロジーを提供し、その後の事業戦略で役立てていただく。いわば、事業全体での「可視化」の実現です。
LSHで早期の新薬申請‐CROと共通の情報基盤
事業の「可視化」を実現可能とする、オラクルの臨床試験データ管理製品が、データの倉庫となるデータウェアハウス・ソリューションの「Oracle Life Sciences Data Hub」(LSH)です。LSHは、臨床開発や市販後の安全性などの異なる臨床試験のデータを一つのデータベースに集約し、データ管理・集計・レポーティングをするためのレポジトリ・解析プログラムツールです。データ解析を効率的に行える環境整備を実現し、より迅速で確実な新薬申請を支援します。
これまではデータウェアハウスを構築して分析を行うためには、業務システムで発生したデータを特定のデータ形式に変換してからデータベースに収納する必要がありました。
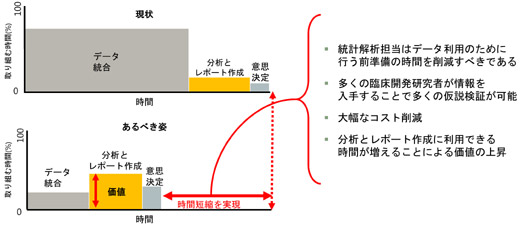
LSHでは、従来のデータウェアハウスとは異なり、分析や解析を行うデータを、業界標準の形式や企業独自の形式で収納できます。これにより、統計解析担当は、情報システム部門などの支援を通じて行うデータ抽出・変換を経ることなく、LSHにある最新データの閲覧・抽出・解析が可能になります。また、高精度のデータ品質担保も可能であるほか、大幅なコスト低減、分析やレポート作成に利用できる時間を増やすことができます。
また、社外のデータソースもデータベースに取り込めるのもLSHの特長の一つと言えるでしょう。新薬枯渇の時代を迎え、製薬各社のビジネスモデルは、旧来の自前主義から決別し、各事業領域でアウトソーシングが加速している状況にあります。例えば、創薬段階ではバイオベンチャーからシーズを導入し、非臨床・臨床試験ではCRO、承認取得後は販売をCSO、製造をCMOに外部委託するビジネスモデルが顕著になってきました。
こうした状況を踏まえ、製薬企業内の部門間はもちろん、パートナー企業との情報連携にどう取り組んでいくかが重要な事業課題となっています。LSHを導入することによって、外部との複雑なやりとりが増えても、組織内外の関係者全てが共通のデータを参照できるため、意思疎通が可能になります。
データ履歴も簡単に追跡‐当局の指摘事項にも対応
LSHは、医薬品の承認審査を行う規制当局との対応にも心強い味方になると思います。最近は、コンプライアンス対応から当局とのやりとりも以前に比べて頻繁になっており、データの提示を求められるケースもしばしば増えています。膨大なデータの中から、根拠となるデータを探し出すのは大変な作業。私が製薬企業に在籍していた頃、承認申請資料に関する内容確認で当局から指摘を受けたときに、10人がかりで必死になってデータを探すなど、困った経験があります。
こうした経験を通じて、承認申請時の最新情報だけでなく、そのデータがいつどこで作成されて、その後どのような項目で変更・追加が行われているかが、一つのデータウェアハウスで状況確認できるシステムが必要だと思いました。実際FDAも、データに記載されている結果について、申請者に対してデータの根拠に関する説明を求めるようになってきており、膨大なデータから必要に応じて必要な情報を取り出せるシステムが今まさに求められてきています。
その点において、最新の情報はもちろん、それまでの変更履歴をも追跡できるLSHは、当局とスムーズなやりとりを行えるツールとして、早期の承認取得をアシストできると確信しています。
ある欧州製薬大手は、外部との連携を持たない、ITでいう「サイロ」の状態を回避するために、LSHを導入しました。もともと、多種のEDCシステムを使っていましたが、現在はグローバルで進行中の複数の試験を一元管理できるよう、自社でその仕掛けをつくっています。
包括的なサービスを提供‐クラウドも一つの選択肢
ライフサイエンス分野での事業基盤の強化に取り組むオラクルは、09年、10年に製薬管理ソフトウェア大手の米レルシスと米フェーズフォワード2社を相次いで買収しました。
もともと、製薬業界向けに展開するITベンダーの多くは、医薬品開発業務の一部領域にだけ強く、レルシスやフェーズフォワードもその代表格でした。しかしハードウェアからソフトウェアまで多様な製品群を持つオラクルの傘下に入ったことで、EDCや安全性情報管理、CTMSなどの製品群をスイート型で提供できるようになりました。
オラクル製品には「SOA」(サービス・オリエンテッド・アーキテクチャー)という考え方が含まれています。データベースやデータウェアハウスを中心として、様々なサービスが動いて、全部門の業務を最適化するというものです。
われわれは、顧客のニーズに応じて製品をつくりこむカスタマイズ型のサービスではなく、受注後すぐに利用可能な業界標準のパッケージ製品を提供しています。もちろん、オラクル製品ではない他社製品をそのまま使っていただくことも可能です。
今後ITをめぐっては、現場の課題に応える「ボトムアップ」で製品が選ばれる時代から、現場・経営の視点で使われる時代になっていきます。ITの費用対効果は、製薬各社の事業戦略によってパフォーマンスが左右されてくるでしょう。これは、単純にデータ収集の期間短縮などのような単一の目的だけでなく、システムとシステムをつなぐことで、より戦略的に多面的にITが使われていくと思います。
われわれはSOAの考え方に立ち、実務レベルではプロジェクトの進捗や日々の予算管理、経営レベルでは将来の開発パイプラインを検討していくためのツールとして、LSHのようなITを提案していきたいと思っています。
一方、必要なときに必要に応じてサービス利用が可能なオンデマンド型のクラウドサービスも推進していきます。従来は莫大なコストをかけてシステムを買うというのが、IT導入体系でした。今後は「サービスを買う」がここに追加されます。
使った分だけを払うITの使い方が一つの選択肢となり、費用対効果がより高まると見ています。特に事業パートナーのCROが利用する上で、オラクルが強みとするクラウドサービスは有用だと認識しています。
日本オラクルでは、企業ITが抱える複雑性を単純化し、顧客のイノベーションを最大化することをスローガンとして掲げています。われわれはITを通じて、製薬企業のライフサイクル全体をサポートできる会社を目指していきます。
日本オラクル株式会社
http://www.oracle.com/jp/index.html